La production du dihydrogène.
Présent en abondance dans le soleil, l'hydrogène gazeux est quasiment absent de notre atmosphère. Il faut donc l’extraire des molécules qui le contiennent. L’hydrogène est produit en utilisant diverses énergies primaires, telles le nucléaire, le gaz naturel*, le charbon, la biomasse* et les énergies renouvelables comme le solaire, l’éolien, l’hydroélectricité et la géothermie.
Il existe plusieurs procédés technologiques permettant de produire l’hydrogène
1) Reformage du gaz naturel.
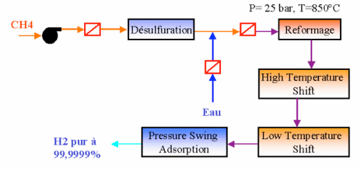
Le reformage à la vapeur consiste à transformer les charges légères d’hydrocarbures en gaz de synthèse (mélange H2, CO, CO2, CH4, H2O et autres impuretés) par réaction avec la vapeur d’eau sur un catalyseur au nickel. Cette transformation a lieu à haute température (840à 950 C) et à pression modérée (de l’ordre de 20à 30 bars). Elle peut être suivie par différentes opérations qui conduisent à la production d’hydrogène mais aussi à l’obtention de carburant de synthèse. Dans tous les cas, la charge d’une unité de vaporeformage peut être du gaz naturel (charge de référence), du méthane.
Le gaz naturel contient essentiellement du méthane. Toutefois, il doit généralement être désulfuré avant d’être dirigé vers l’unité de vaporeformage. Pour maximiser la production d’hydrogène, les deux principales réactions chimiques à mettre en œuvre sont la production de gaz de synthèse et la conversion du CO.
Réaction 1 : production de gaz de synthèse
CH4 + H2O + chaleur=> CO + 3 H2
Cette réaction correspond au vaporeformage. Elle nécessite un apport de chaleur pour permettre à la réaction d’avoir lieu : on dit que cette réaction est endothermique. Cette étape est suivie de la conversion du monoxyde de carbone (CO) en dihydrogène (H2) et en dioxyde de carbone (CO2) grâce à de la vapeur d’eau (H2O) et un catalyseur (sensible à la présence de soufre qu’il ne tolère qu’en très petites concentrations) permettant de maximiser la production d-hydrogène.
Réaction 2: conversion du CO
CO + H2O =>CO2 + H2 + chaleur
Cette réaction est généralement réalisée en une ou deux étapes à des niveaux de température allant de 200 °C à 475 °C. Cette réaction, contrairement à la réaction de vaporeformage, produit de la chaleur : on dit que cette réaction est exothermique.
Globalement, l’ensemble des deux réactions est endothermique et nécessite donc une source de chaleur. La chaleur utile à la réaction est généralement produite en brûlant une partie du gaz naturel et des gaz en sortie du système de purification.
Les gaz résultants de la réaction 2 contient approximativement 70 à 80% d’hydrogène et d’autres gaz tels que le dioxyde de carbone, le méthane, de la vapeur d’eau, et du monoxyde de carbone.
Afin d’obtenir de l’hydrogène pur, une quatrième et dernière étape est nécessaire . Elle consiste à faire passer ce gaz à travers un tamis moléculaire de type PSA (Pressure Swing Absorber) permettant de séparer l’hydrogène des autres composants.
Le vaporeformage peut également être utilisé pour produire de l’hydrogène à partir d’autres combustibles tels que l’éthanol, le propane et le gasoil.
b)Oxydation partielle
L’oxydation partielle peut être effectuée sur un plus grand nombre de produits que le vaporeformage allant du gaz naturel aux résidus lourds, et même au charbon.
Les deux principales réactions de ce procédé, à l’instar du vaporeformage, sont la production de gaz de synthèse :
Réaction 3: oxydation partielle
CH4 + ½ O2 => CO + 2 H2 + chaleur
Et la conversion du monoxyde de carbone en hydrogène et dioxyde de carbone est similaire à celle décrite dans le cas du vaporeformage.
Globalement, le bilan des deux réactions est exothermique.
c)Reformage autothermique
Comme nous l’avons vu précédemment, la réaction de vaporeformage est endothermique, alors que la réaction d’oxydation partielle est exothermique. La première réaction a donc besoin de chaleur, alors que la deuxième produit de la chaleur.
Le reformage autothermique utilise cette complémentarité. Son principal avantage est de compenser dans un même réacteur les réactions endothermiques du vaporeformage par les réactions exothermiques de l’oxydation partielle.
2)Gazéification du charbon.
On mélange le charbon à de l'eau et de l'air à 1000°C et sous haute pression, et on obtient un gaz contenant en majorité du CO et de l'hydrogène. On peut alors séparer H2 et CO des autres impuretés. Le CO est éliminé par Water Gas Shift, le CO2 est séparé du reste et pourra être stocké (Carbon sequestration). Le rendement électrique serait de 45 % dans un premier temps et pourrait aller jusque 60% dans le futur.
3)Gazéification de la biomasse
La biomasse* peut être gazéifiée et convertie en hydrogène et électricité à partir d’un procédé très similaire à la gazéification du charbon.
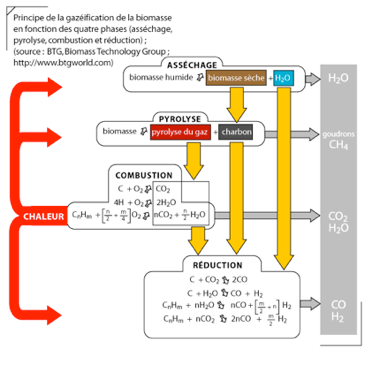
La biomasse, étant une énergie renouvelable pour produire de l'électricité, elle peut également permettre la production de l'hydrogène par le procédé de électrolyse.
1)Reformage de carburants liquides issus de la biomasse.
La biomasse peut également être convertie en éthanol ou autre agrocarburants liquides grâce à des procédés similaires à la gazéification. Ceux-ci peuvent, contrairement à l’hydrogène qui doit être comprimé, être transportés à un coût relativement bas à des points d’utilisation et reformé sur place pour produire de l’hydrogène. Le reformage du carburant liquide est similaire au reformage du gaz naturel.
2)Décomposition thermochimique de l’eau.
La décomposition thermochimique de l’eau exploite la chaleur d’une source haute température (500 °C à 2000 °C) en utilisant une série de réactions chimiques pour produire de l’hydrogène.
Les composants chimiques utilisés lors de la réaction chimique sont réutilisés dans une nouvelle réaction créent une boucle fermée appelée « cycle thermochimique ». Durant ces cycles, seules l’eau et l’énergie thermique sont consommées.
La haute température utile à réaliser un cycle thermochimique permettant de décomposer l’eau peut provenir des centrales nucléaires nouvelles générations en développement ou, encore, en utilisant l’énergie solaire au moyen de concentrateurs.
a)Décomposition thermochimique à partir de concentrateurs solaires.
Un concentrateur solaire utilise des miroirs et des lentilles pour concentrer la lumière d’environ 2000 C. La chaleur produite et la température élevée permettent de produire de l’hydrogène à partir d’un cycle thermochimique.
b)Décomposition thermochimique à partir de centrales nucléaires haute température.
Les centrales nucléaires haute température peuvent, de la même manière que les concentrateurs solaires, produire de la chaleur aux alentours de 800 C à 1000 C permettant la décomposition thermochimique de l’eau.



